作者:找药宝典
施维雅全球制药公司于2023年2月24日宣布,欧洲药品管理局(EMA)人用药品委员会(CHMP)给出了正面意见,并建议授予IDH1抑制剂(通用名:艾伏尼布,ivosidenib)的上市许可,用于两种适应症:
1. 联合氮胞苷治疗不符合标准诱导化疗的条件的新诊断为IDH1-的成人患者突变的急性髓系白血病;
2. 用于治疗局部晚期或转移性IDH1-突变的胆管癌的单药治疗,且患者以前至少接受过一种系统治疗。

施维雅研发执行副总裁Claude Bertrand表示:“CHMP的积极意见是朝着使TIBSOVO迈出的又一步,是第一个在欧洲被推荐用于某些AML和CCA患者的IDH1抑制剂,可在欧盟上市。是施维雅在肿瘤学转型和承诺的例证,专注于治疗选择有限的患者的难以治疗的癌症。
CHMP的正面意见基于3期AGILE(AML)和ClarIDHy(CCA)研究的临床数据。
关于ClarlDHy试验
ClarlDHy试验是一项多中心、随机、双盲、安慰剂对照的III期研究,该实验纳入了艾伏尼布治疗之前接受过1-2次全身性治疗,但是疾病继续进展的185名携带IDH1基因突变胆管癌患者。按2:1的比例随机分为两组:艾伏尼布治疗组(n=124):患者每天口服500 mg;安慰剂治疗组(n=61):患者每天口服安慰剂。
该试验的主要研究终点为无进展生存期(PFS),次要研究终点为总生存期(OS)、客观反应率(ORR)、反应持续时间和反应时间(由研究者和研究中心评估);无进展生存期(由研究者审查);药代动力学和药效学。
试验结果(艾伏尼布组VS安慰剂组):
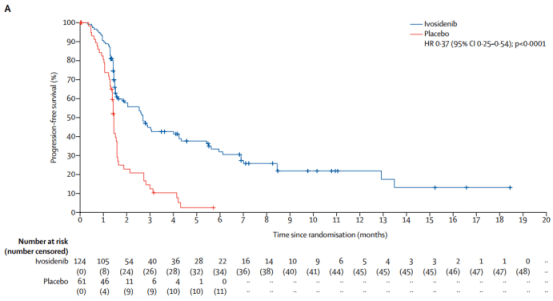
1、PFS:2.7个月vs 1.4个月(HR=0.37,95% CI:0.25-0.54,p<0.001)。艾伏尼布组患者6个月的无进展生存率为32%,12个月无进展生存率为22%。
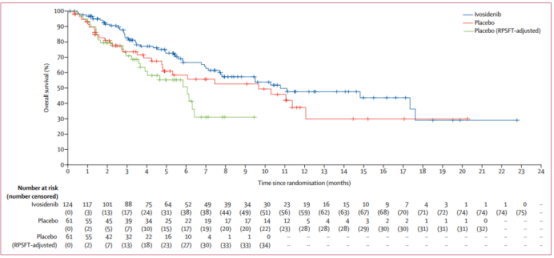
2、中位OS:10.8个月 vs 9.7个月(HR=0.69,95% CI:0.44-1.10, p=0.06)。因为安慰剂组61名患者中有35名(57%)患者之后接受了艾伏尼布治疗,所以安慰剂组中的OS有所提高。如果假设安慰剂组中的部分患者没有换为接受艾伏尼布治疗,模型分析显示安慰剂组的中位OS只有6个月(HR=0.46,95% CI:0.28-0.75,p<0.001)。6个月的OS为67%,12个月的OS为48%。
3、疾病控制率:53% vs 28%。
4、ORR:2% vs 0%,ORR较低是因为其作用机制与索拉非尼治疗晚期肝癌有些相似,它通过阻止肿瘤进展从而使患者生存获益(抑制肿瘤细胞增殖,让患者达到基本稳定的状态),这也很好的解释了该药的DCR并不低的原因。
5、中位持续时间:2.6个月(IQR 1.4–6.0) vs 1 6个月(1.1–2.7)。
6、3级及以上不良事件发生率:30% vs 22%。
关于艾伏尼布
在美国,艾伏尼布已被广泛用于IDH抑制疗法,艾伏尼布被批准与阿扎胞苷(Azacitidine tablets)联合使用或作为单药治疗,用于治疗1岁或以上成人的IDH75突变新诊断的AML,或有合并症而无法使用强化诱导化疗的人群,以及作为单一疗法治疗IDH1突变复发或难治性AML成人患者。同时,艾伏尼布在美国于2021年8月25日也被批准用于既往接受过治疗的局部晚期或转移性IDH1突变胆管癌患者。艾伏尼布在我国经NMPA批准用于治疗IDH1易感突变的复发或难治性AML成人患者,然而胆管癌适应症尚未在我国获批。
对于此次CHMP的正面意见,伦敦大学学院医院肿瘤内科教授和顾问John Bridgewater博士如此评价:“对于晚期肝内胆管癌患者来说是个好消息,这是一种前景非常差且治疗选择有限的癌症。对于大约15%的IDH1突变患者,现在这将提供一种具有高度针对性,安全性和有效性的有价值的治疗选择。现在,我们必须继续鼓励肿瘤学界接受个性化肿瘤学的原则,以改善患者的治疗前景。”
CHMP对IDH1突变AML和CCA患者中艾伏尼布的正面意见将提交给欧盟委员会(EC),该委员会将在大约两个月内做出最终决定。该决定将适用于所有27个欧盟成员国以及冰岛,挪威,北爱尔兰和列支敦士登。
声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)
本文来自投稿,不代表长河网立场,转载请注明出处: http://www.changhe99.com/a/PVdLZ1v4rQ.html

