作者:水木未来

图 1 Nature 论文截图
2023年2月22日,美国华盛顿大学的David Baker研究组在Nature发表题为“De novo design of luciferases using deep learning” 的研究工作(图1)。Baker团队将此前他们在蛋白质设计领域开发的多种方法进行融合,使用基于深度学习的 “family-wide hallucination” 方法从头设计出能特异性催化底物的荧光素酶LuxSit。这项工作从头创建了具有高活性和特异性的生物酶催化剂,是计算酶设计的一项重要里程碑。
荧光素酶(Luciferase)是一种常见的生物发光酶,无需激发光,它能催化荧光素(Luciferin)在存在氧气的条件下发光(图2)。
图 2 荧光素酶催化荧光素氧化发光
荧光素酶催化荧光素发光的原理被广泛应用于生物医学各个领域,特别是用于生物标记、高通量筛选和生物成像等应用中。而现在,荧光素酶的设计改造发展还存在一些困难: 已被鉴定的天然荧光素酶种类很少,识别底物的特异性不高,天然荧光素酶也不会识别具有更理想的光物理性质的合成荧光素,一些荧光素酶需要多个二硫键来稳定其结构,因此在哺乳动物细胞中表达时容易发生错误折叠。因此,表达更稳定、底物识别特异性更高的荧光素酶成为了研究发展的需要。而基于深度学习的蛋白质从头合成设计赋予了这项研究崭新的可能。
在这项研究中,研究者以人工合成荧光素DTZ(diphenylterazine)作为研究的催化底物(图3),因为它具有高量子产率、红移发射、有利的体内药代动力学以及发光无需辅因子等特点。

图 3 Diphenylterazine (DTZ) 是一种生物发光剂。Diphenylterazine 本身仅产生很少的背景,导致极好的信噪比
从头设计酶需要将底物的结合口袋和催化底物的活性位点同时纳入蛋白骨架。首先是对蛋白骨架的结构设计。研究人员将DTZ与4000个天然小分子结合蛋白进行对接。他们发现nuclear transport factor 2(NTF2)蛋白骨架的折叠结构和DTZ具有良好的形状互补性,因此选择NTF2蛋白家族的骨架结构对DTZ的结合口袋做进一步的优化设计。
此前,David Baker组曾报道了一系列从序列-结构关系出发的蛋白质设计相关算法(图4)。“Hallucination”方法指在序列空间中进行采样,使用神经网络来优化,从而产生有意义结构的序列,这项方法保证了序列的多样性;“Rosetta sequence-design approaches” 则是从目标结构出发,生成符合该结构的氨基酸序列,从而保证了结构的特异性;而trRosetta用来做结构预测。

图 4 David Baker团队此前报道相关算法
研究者融合使用上述三种方法,即 “family-wide hallucination”,从2000个天然NTF2的序列开始,历经搜索、幻想与生成,获得了1615个符合要求的骨架序列(图5)。

图 5 荧光素酶骨架结构的幻想设计
在蛋白骨架结构基础上,研究者们继续对催化底物的活性中心进行设计。此前的实验数据表明,DTZ在负离子状态下具有最佳的反应活性,因此在骨架结构上保留了一个固定的精氨酸以维持底物的负离子状态。在对活性中心的设计上,研究者结合他们此前开发的RifGen方法,来模拟底物周围最佳的氨基酸结构组合。将活性中心的设计结构与之前获得的蛋白骨架对接,再通过引入疏水相互作用和氢键网络来做进一步的筛选,从50000个对接组合中最终筛选出7648个候选结构(图6)。

图 6 荧光素酶活性中心的设计
利用荧光素酶筛选系统(图7),研究者们表达了上述7648个候选蛋白,在实验中发现有3个成功显示荧光素酶催化活性的蛋白酶,其中有一个活性最高的,它们将其命名为LuxSit (取lux sit拉丁语中let light exist之义)。

图 7 荧光素酶筛选系统
随后研究者将LuxSit蛋白表达纯化,并对其生物物理性质进行鉴定(图8)。实验结果表明,LuxSit包含117个氨基酸,分子量约为13.9 kDa, 比已知的所有天然荧光素酶的分子量都小。trRosetta和Alphafold2对LuxSit的预测结构基本一致,在体外实验中它也能成功催化底物DTZ发光。至此研究者们已经实现了对人工荧光素酶的从头合成。
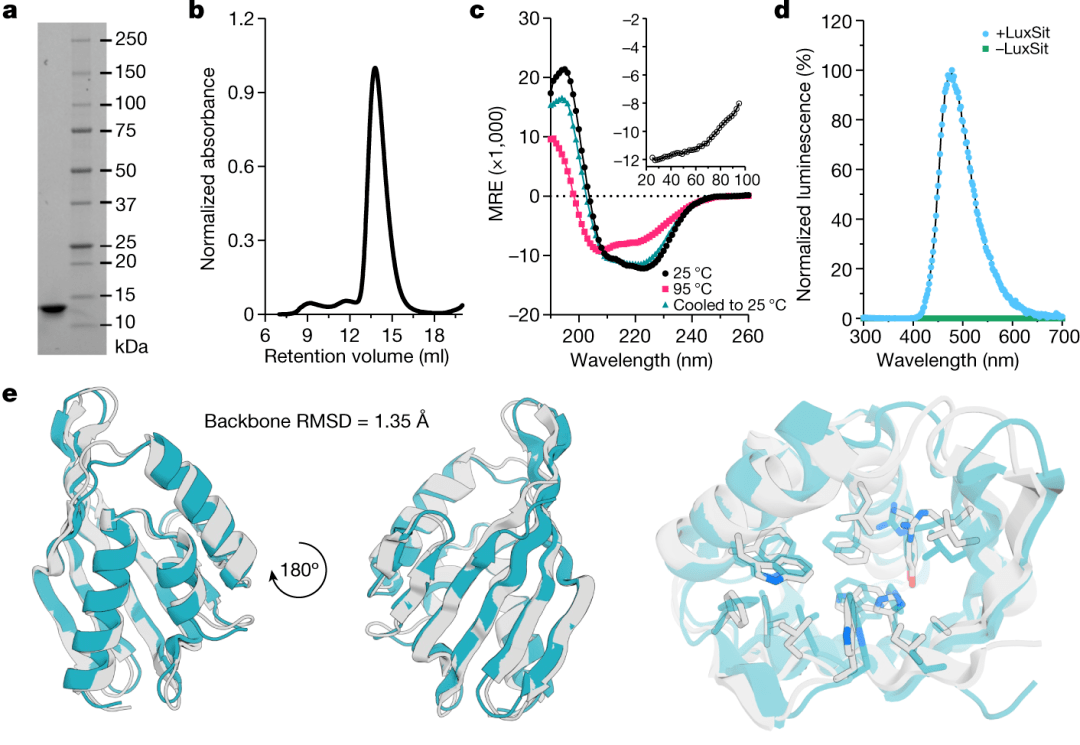
图 8 LuxSit的生物物理性质鉴定
在LuxSit的经验基础上,研究者们又针对另一种荧光素底物设计了酶催化剂,也成功的实现了底物发光的反应;并对LuxSit设计了一些突变位点,以期获得更高的催化活性,在实验验证中也取得了明显的改善(图9)。

图 9 Luxsit的优化设计
综上,本文介绍了一种基于深度学习的“family-wide hallucination”方法,该方法生成大量理想化的蛋白质结构,其中包含多种口袋形状和编码它们的设计序列。使用这些蛋白骨架成功设计了人工荧光素酶,这些酶具有很高的底物选择特异性。这是从头合成生物酶的一次成功实践,这一经验有望用于其他类型蛋白酶的设计中。这是我们设计改造生物酶的一个崭新开始。
参考文献
1. Syed, A. J., , & Anderson, J. C., (2021). Applications of bioluminescence in biotechnology and beyond. Chemical Society reviews, 50(9), 5668–5705. https://doi.org/10.1039/d0cs01492c
2. Anishchenko, I., Pellock, S. J., Chidyausiku, T. M., Ramelot, T. A., Ovchinnikov, S., Hao, J., Bafna, K., Norn, C., Kang, A., Bera, A. K., DiMaio, F., Carter, L., Chow, C. M., Montelione, G. T., & Baker, D. (2021). De novo protein design by deep network hallucination. Nature, 600(7889), 547–552.
https://doi.org/10.1038/s41586-021-04184-w
3. Cao, L., Coventry, B., Goreshnik, I., Huang, B., Sheffler, W., Park, J. S., Jude, K. M., Marković, I., Kadam, R. U., Verschueren, K. H. G., Verstraete, K., Walsh, S. T. R., Bennett, N., Phal, A., Yang, A., Kozodoy, L., DeWitt, M., Picton, L., Miller, L., Strauch, E. M., … Baker, D. (2022). Design of protein-binding proteins from the target structure alone. Nature, 605(7910), 551–560. https://doi.org/10.1038/s41586-022-04654-9
4. Norn, C., Wicky, B. I. M., Juergens, D., Liu, S., Kim, D., Tischer, D., Koepnick, B., Anishchenko, I., Foldit Players, Baker, D., & Ovchinnikov, S. (2021). Protein sequence design by conformational landscape optimization. Proceedings of the National Academy of Sciences of the United States of America, 118(11), e2017228118.
https://doi.org/10.1073/pnas.2017228118
5. Yang, J., Anishchenko, I., Park, H., Peng, Z., Ovchinnikov, S., & Baker, D. (2020). Improved protein structure prediction using predicted interresidue orientations. Proceedings of the National Academy of Sciences of the United States of America, 117(3), 1496–1503. https://doi.org/10.1073/pnas.1914677117
供稿 | 王雨蒙
审稿 | 孔方
责编 | 囡囡
排版 | 可洲
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)
本文来自投稿,不代表长河网立场,转载请注明出处: http://www.changhe99.com/a/oV6MZeDMrg.html

