作者:找药宝典
近日,第20届美国临床肿瘤学会胃肠肿瘤研讨会(ASCO GI 2023)顺利召开。会上Astellas发布了关于CLDN 18.2单克隆抗体唑贝妥昔单抗用于晚期胃或胃食管结合部(GEJ)腺癌一线治疗的3期SPOTLIGHT研究的详细数据:唑贝妥昔单抗+ mFOLFOX6组的中位无进展生存期(PFS)显著超过安慰剂+ mFOLFOX6组。中位总生存期(mOS)也显著延长,最长可超过18个月。由于靶向claudin-18.2的单克隆抗体良好的临床效果和较低级别的不良反应,它有望成为一种新的治疗方案并改变胃癌一线治疗的格局。本文就claudin-18.2在肿瘤临床中应用进行分析,帮助大家更好地了解claudin-18.2单抗的作用。
01、claudin18.2 靶点是什么?
紧密连接蛋白claudin18.2 (CLDN18.2)是紧密连接蛋白家族成员claudin18的一种亚型,是一种高选择性的生物标志物,在正常组织中表达有限,常在胃癌/胃食管结合部(GC/GEJ)癌、乳腺癌、结肠癌、肝癌、头颈癌、支气管癌和非小细胞肺癌等多种原发性恶性肿瘤的发生发展过程中异常表达。CLDN18.2参与肿瘤细胞的增殖、分化和迁移。最近的研究发现,CLDN18.2表达可作为这些肿瘤诊断和治疗的潜在特异性标志物。CLDN18.2具有独特的表达模式,已成为不同肿瘤尤其是胃癌靶向治疗的独特分子;例如,已经开发出唑贝昔单抗(zolbetuximab, claudximab, IMAB362)等药物,这是一种抗CLDN18.2的单克隆抗体(mAb)。
02、胃癌中的claudin18.2
Claudin-18有两种可选择性剪接的变异体:肺中的claudin-18.1和胃中的claudin-18.2。Claudin-18.2在原发性胃癌及其转移灶中保留,也可在胰腺、食管、卵巢、肺和结肠炎相关的结直肠肿瘤中发现。胃上皮的Claudin-18.2调节细胞谱系分化,并阻止细胞旁胃酸从胃腔泄漏到黏膜下间隙。细胞旁H渗漏促进了胃炎的进展。幽门螺杆菌(h.p ylori)感染6个月后,claudin-18在小鼠中的表达减弱,其表达随着时间的推移而减少。Citation32在有和无幽门螺杆菌感染的小鼠中,claudin-18.2的缺失导致了细胞旁H渗漏,并促进了胃肿瘤的形成。此外,在claudin-18敲除小鼠中,C-X-C基序趋化因子5 (CXCL5)、toll样受体2 (TLR2)和CD44剪接变异体的表达水平在胃癌发生过程中增加。这些研究表明,claudin-18.2敲除小鼠表达claudin-18.1, claudin-18.1定位于胃黏膜的紧密连接。与claudin-18.2不同的claudin-18变异体被表达,并在保护胃组织中发挥作用。
03、靶向claudin18.2的单克隆抗体——Zolbetuximab
唑贝妥昔单抗(Zolbetuximab, claudximab,以前称IMAB362)是一种小鼠嵌合单克隆抗体,具有与cldn18特异性结合的人IgG1恒定区2。基因重组后可在仓鼠卵巢细胞中表达。唑贝妥西单抗可以通过CLDN18.2蛋白的第一个胞外结构域高亲和力地特异性识别并结合CLDN18.2蛋白,而不与任何其他claudin家族成员交叉结合。唑贝妥昔单抗ELISA的估计检测下限低至0.3 ng/ml。唑贝妥昔单抗已被证明在体内和体外对cldn18具有高度选择性2,与主要在肿瘤细胞中表达的癌症特异性靶点结合,而在健康组织中很少或没有结合。它介导了对表达CLDN18.2的胃癌细胞系的有效和靶向选择性抗体依赖性细胞介导的细胞毒性(ADCC),并诱导了补体依赖性细胞毒性(CDC)介导的对胃癌中表达CLDN18.2的肿瘤细胞的溶解。这种独特的癌细胞选择性使我们能够在降低毒性的同时发挥最大的抗癌效力,从而扩大了治疗窗口并提供了最佳剂量。
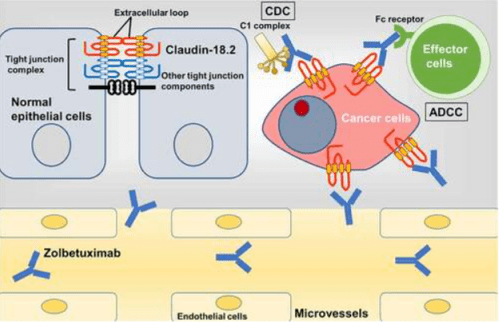
04、Zolbetuximab与相关胃癌的临床研究
唑贝昔单抗在体外也可诱导CLDN18.2蛋白阳性PC细胞凋亡,且ADCC和CDC的幅度与细胞表面CLDN18.2水平直接相关。然而,唑贝妥昔单抗抑制肿瘤细胞增殖和凋亡的确切机制尚不清楚。在临床前和I期临床研究中,15例晚期GC或GEJ癌患者中进行的一项ⅰ期研究表明,虽然大多数患者在单次静脉输入唑贝昔单抗后4-5周出现疾病进展,但600 mg/m2剂量组的1例患者达到并维持了约2个月的疾病稳定。 NCT01630083研究纳入了161例≥40%肿瘤细胞CLDN18.2表达≥2+且不适合曲妥珠单抗治疗的晚期/复发性胃癌和GEJ患者,患者按1∶1的比例随机接受EOX一线治疗(表柔比星50 mg/m2和奥沙利铂130 mg/m2第1天,卡培他滨625 mg/m2, 2次/ d,第1 ~ 21天;Qd22)联合或不联合唑贝昔单抗(负荷剂量800 mg/m2,第1天600 mg/m2, qd21)。结果显示,唑贝妥昔单抗联合一线化疗可诱导临床相关的无进展生存(PFS)和总生存(OS)获益,具有良好的风险/获益特征。唑贝妥昔单抗联合EOX改善了PFS。此外,在CLDN18.2表达非常高(≥70%肿瘤细胞中≥2+强度)的亚群中,疗效更显著。临床研究已经证实了唑贝昔单抗在cldn18.2阳性肿瘤患者中的安全性和有效性。常见的治疗相关不良反应多为1 ~ 3级,主要为恶心、呕吐。 唑贝妥昔单抗联合表柔比星、奥沙利铂和卡培他滨(希罗达)(EOX)与单独EOX用于cldn18.2阳性晚期GC和GEJ腺癌患者一线治疗的一项随机ⅱ期研究(FAST)显示,两者的无进展生存期(PFS)和无进展生存期(PFS)均优于单独EOX。与EOX单独治疗相比,唑贝妥昔单抗+ EOX治疗显著改善。在≥70%肿瘤细胞中CLDN18.2中度至强表达的患者中,这一显著的PFS获益得以保留。总体人群的PFS也有显著改善。
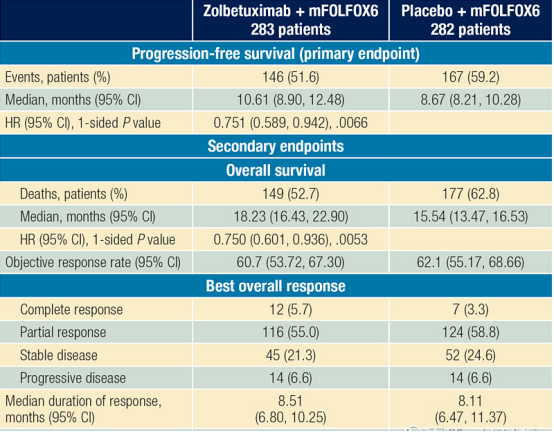
在SPOTLIGHT试验中,参与者以1∶1的比例被随机分组,分别接受唑贝昔单抗+ mFOLFOX6(283例参与者)或安慰剂+ mFORFOX6(282例参与者)治疗。主要终点是无进展生存期。总生存期是次要终点,仅在无进展生存期达到统计学显著性时计算。参与者的中位年龄为62岁,62%为男性,69%为非亚裔,31%为亚裔。77%的参与者的原发部位是胃,22.6%有≥3个器官的转移,结果显示,唑贝妥昔单抗联合mFOLFOX6显著改善了无进展生存期和总生存期,这一结果在分析的大多数亚组中一致。在唑贝妥昔单抗联合mFOLFOX6组中,最常报告的治疗相关不良事件包括恶心(唑贝妥昔单抗组vs安慰剂组,81.0%vs 60.8%)、呕吐(64.5%vs 34.5%)和食欲下降(47.0%vs 33.5%)。两个治疗组的严重不良事件发生率相似(唑贝昔单抗+mFOLFOS6组为44.8%,安慰剂+mFORFOX6组为43.5%)。
05、CLDN18精准靶向引导晚期胃癌精准医疗
唑贝妥昔单抗是自十多年前曲妥珠单抗以来第一个免疫检查点抑制剂以外的分子靶向疗法,在晚期胃癌和GEJ癌的一线治疗中显示出统计学上显著的生存获益 。由于CLDN18.2在特定肿瘤组织中高度选择性和稳定表达,近年来成为抗肿瘤药物的热门分子靶点。一些研究揭示了非常有前景的cldn18.2靶向药物的结果。虽然目前全球范围内尚无针对CLDN18的药物获批临床应用,但全球研发表明,针对CLDN18.2的候选药物可能成为继her -2靶向药物之后的胃癌靶向治疗的重要替代药物。我们相信,随着研究的不断进展,新的cldn18.2靶向药物将提高诊断和治疗水平,使更多的恶性肿瘤患者获益。
声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。
本文版权归找药宝典所有,任何个人或机构转载需获得找药宝典授权,在授权范围内使用,并标注来源“找药宝典”。
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)
本文来自投稿,不代表长河网立场,转载请注明出处: http://www.changhe99.com/a/MOreZ5Gbw2.html

